Введение
«Неразумно недооценивать противника, обладающего эволюционным преимуществом в три миллиарда лет“ (Sayers, 2004). Появление резистентности к антимикробным препаратам все более ограничивает возможные методы лечения медицины человека и ветеринарии. Не следует путать вирулентность и резистентность. Вирулентность относится к способности организма вызывать заболевание, в то время как резистентность относится к способности организма избегать вреда, в особенности вызванного антимикробными препаратами. Часто считают, что резистентность и вирулентность возникают вследствие одинаковых механизмов у микробов; более новые штаммы микробов, хотя часто взаимоисключающие, могут быть и вирулентными и резистентными.
Резистентность к антимикробным препаратам может быть врожденной или приобретенной, последнее происходит вследствие мутаций хромосом (вертикальных) или передачи генетической информации (горизонтальной или общей). Общие механизмы резистентности включают в себя трансдукцию (бактериофаг), трансформацию (свободная ДНК) и конъюгацию. Наиболее распространенные биохимические механизмы резистентности включают в себя механизмы, препятствующие движению или удерживанию препарата в клетке (порины и эффлюксные насосы, при этом и те и другие могут способствовать множественной лекарственной резистентности), изменение мишени (например, рибосомы, топоизомеразы, пенициллинсвязывающие белки), деструкцию ферментов (например, бета-лактамазы, ацетилирование хроламфениколов или аминогликозидов). Способность организмов развивать резистентность к антимикробным препаратам различна в зависимости от вида и штамма. Некоторые представляют собой терапевтическую проблему вследствие резистентности (обычно множественной, МЛР), которая быстро снижает эффективность даже новых антимикробных препаратов (E coli,Klebsiella pneumoniae, Salmonella, Staphyloccoccus aureus или pseudintermedius). Появление бета-лактамазы расширенного спектра (БЛРС) является примером быстрой и неумолимо адаптивной природы микробов в отношении новых препаратов, предназначенных для борьбы с ними. БЛРС кодированы большими плазмидами, которые могут передавать информацию между штаммами, а также различными видами организмов. Генная мутация передает резистентность более новым цефалоспоринам. БЛРС наиболее часто присутствуют в Klebsiella spp, E. coli или Proteus mirabilis (3,1-9,5%), но также могут быть обнаружены в других членах энтеробактерий и в Pseudomonasaeruginosa. В данной статье будет рассмотрена резистентность, проявляемая Escherichia coli и в меньшей степени Staphylococcus.
Профилактика резистентности
Три меры:
- Сократить. Так как предшествовавшая антибактериальная терапия является одним из важнейших факторов, связанных с резистентностью, будут важны подходы, которые сводят к минимуму беспорядочное применение антибактериальных препаратов. Это включает в себя отказ от использования антибактериальных препаратов без необходимости, по возможности быстрое прекращение использования, смена антибактериальных препаратов, сужение спектра эмпирических антибиотиков и смена применения антибактериальных препаратов на основе стандартного графика.
- Разработать. Необходимо разработать режим дозирования, при котором в месте инфекции достигаются достаточные концентрации препарата, прекращающие, а не просто замедляющие рост микробов. Мертвые микроорганизмы не мутируют! Это означает выбор наилучшего препарата и далее обеспечение того, что режимы дозирования достигают убивающих концентраций препарата в месте инфекции.
- Дезинфицировать. Это включает в себя совершенствование инфекционного контроля посредством выбранных процедур дезинфекции, профилактику горизонтальной передачи через мытье рук, использование дезинфицирующих веществ, использование перчаток и халатов, альтернативы мылу, улучшение нагрузки и условий для работников здравоохранения и использование специальных помещений для лечения потенциальных возбудителей инфекции (т.е. перевязочных, в которых возможно легко проводить уборку).
Уропатогены: кишечная палочка
Вирулентность. E. coli служит примером патофизиологии ИМП. Кишечная палочка быстро делится, ее популяция может удваиваться каждые 20 минут. Кроме того, она является очень мутагенной, и спонтанные мутации происходят в новом потомстве от 1 на 100 тысяч до 1 на миллиард (примем, что 1 г кала содержит 100 миллионов кишечных палочек), таким образом обеспечивая возможность спонтанной мутации даже при отсутствии стимулов, таких как лекарственные препараты. Хотя кишечные палочки обычно являются непатогенными, присутствие факторов вирулентности в некоторых штаммах позволяют классифицировать кишечную палочку на 6 групп, способных вызывать кишечные заболевания: внекишечная E coli (ExPEC) является недавно классифицированным болезнетворным микроорганизмом; в эту категорию включаются UPEC (уропатогенные). И у людей и у собак бактерии, инфицирующие мочевые пути, обычно имеют фекальное происхождение, при этом частота инфицирования конкретным штаммом зависит от вирулентности организма. Сюда входят UPEC, а также другие организмы, такие как Enterococcus. Уропатогенные кишечные палочки (UPEC) могут вызывать инфекцию внекишечной локализации, так как они содержат приспособленные к особым условиям факторы вирулентности и, как таковые, отличаются от условно-патогенных микроорганизмов. Попав в мочевой пузырь, восходящая инфекция по уретре к мочевому пузырю может быть далее осложнена инфекцией в уретре и почке, если штамм содержит Р фимбрии или К антиген, в особенности в присутствии везикуло-уретрального рефлюкса. Инфекция также может проявляться в предстательной железе. Escherichia coli содержит адгезины, которые связываются с гликолипидными рецепторами.
Маннозосодержащие рецепторы также были обнаружены у людей; E. coli (и другие энтеробактерии) переносит манноза-специфические адгезины, которые, попав в нижние мочевые пути, оказываются основным механизмом адгезии для E. coli и поэтому важны для колонизации мочевого пузыря или нижних структур. В противоположность этому манноза-устойчивые фимбрии и другие адгезины оказываются крайне важными для колонизации ренальных структур. Связывание рецептора и адгезина изменяет клетку с рецептором. Как только E. coli склеится с уроэпителием, образование биопленки защитит ее от повреждения клеткой хозяина антибактериальных препаратов. Сообщества биопленки являются сложными и тонко организованными. Биопленка может защитить микробы таким образом, что они становятся сенесцентными и менее восприимчивыми к антибактериальной терапии. Такие клетки могут оставаться под уроэпителиальными клетками до тех пор, пока они не отшелушатся, но снова станут активными, и инфицирование продолжится. Гены, кодирующие вирулентность, расположены на островах патогенности; обычно такие организмы не несут генов резистентности. Степень тяжести ИМП может соотноситься со степенью прилипания к уроэпителиальным клеткам. Организмы, вызывающие острый пиелонефрит у людей, характеризуются более высокой степенью прилипания по сравнению с организмами, вызывающими бессимптомную бактериурию. Эти E. coli производят несколько вирулентных факторов, в том числе гемолизин и аэробактин, и могут противодействовать антибактериальному действию сыворотки. Токсины, такие как эндотоксин, действуют вместе с прилипанием и вызывают воспаление.
В конечном итоге, определение факторов вирулентности может облегчить обнаружение инфекции в тканях помимо уроэпителия, обеспечивая направление лечения.
Резистентность
Желудочно-кишечная среда благоприятна для развития резистентности. Микробы среды поддерживают экологическую нишу, подавляя конкуренцию через секрецию антибиотиков. Как таковые, условно-патогенные организмы постоянно подвержены действию антибиотиков. Однако, микробы, производящие антибиотик, а также окружающая нормальная флора резистентны к антибиотику. Таким образом, гены резистентности развиваются наряду с генами, управляющими выработкой антибиотиков, и организмы «настраиваются» на развитие резистентности. Микрофлора ЖКТ может служить резервуаром генов резистентности. Воздействие антибактериальных препаратов может облегчить выживание штаммов, которые либо спонтанно мутировали, либо приобрели резистентность иными средствами. Резистентность может легко передаваться другим потенциально более вирулентным организмам.
Кишечная палочка быстро вырабатывает резистентность, в особенности связанную с множественной резистентностью (МЛР), при воздействии выбранных антибактериальных препаратов. Еще большая проблема в том, что резистентность легко передается более патогенным организмам.
В человеческой медицине кишечная палочка выработала резистентность к фторсодержащим хинолонам, бета-лактамам или к тем и другим. Именно в среде грамотрицательных организмов выделяется бета-лактамаза расширенного спектра (БЛРС). Появление бета-лактамазы расширенного спектра (БЛРС) является примером неумолимой адаптивной природы микробов в отношении «дизайнерских» лекарственных препаратов, целью которых является недопущение появления резистентности. БЛРС кодированы большими плазмидами, которые могут передавать информацию между штаммами, а также различными видами организмов. Генная мутация передает резистентность более новым цефалоспоринам, в том числе цефатоксиму, а также цефподоксиму или цефалоспоринам 4-го поколения, в том числе цефепиму (более не продается в США). Цефипим приводили как возможно эффективный против БЛРС. Воздействие на клавулановую кислоту и сульбактам неясно, хотя их использование вместо цефалоспоринов, по-видимому, снижает появление БЛРС и может снижать возникновение других устойчивых патогенов, таких как Clostridium difficile и устойчивых к ванкомицину энтерококков. БЛРС наиболее часто обнаруживается в Klebsiella spp, E. coli or Proteus mirabilis (3,1-9,5%), но также были обнаружены в других членах энтеробактерий и вPseudomonas aeruginosa.
Резистентность к фторхинолонам также типична. Такая резистентность обычно связана с точечными мутациями в топоизомеразах (ДНК-гираза и топоизомераза IV) и подобно бета-лактамазе находится внутри класса. Однако в присутствии продолжительного приема препарата индуцируются эффлюксные насосы. Такие насосы служат для удаления токсичных соединений из организма, включая антибактериальные средства. Были охарактеризованы 5 эффлюксных насосов; они также связаны с поринами и характеризуются широкой субстратной специфичностью. Таким образом, они могут передавать множественную резистентность. Культура (выше) и антибиограмма (ниже) служат типичным примером моделей резистентности, которые могут возникать у животных, получивших фторхинолоны, и у которых возникла резистентность.
Мы показали воздействие МЛР к кишечной палочке в некоторых наших исследованиях. У здоровых нормальных собак мы показали воздействие на фекальную кишечную палочку амоксициллина при дозировке 10 мг/кг два раза в сутки и энрофлоксацина - 5 мг/кг раз в сутки перорально 7 дней. При обоих препаратах 100% кишечной палочки стали резистентными к препарату, показав высокий уровень (более чем в 8 раз выше пограничного значения МИК). Для амоксициллина эта резистентность была ограничена бета-лактамами и в отдельных случаях тетрациклинами или сульфаниламидами; при этом резистентность обычно устранялась в течение 3 недель. Резистентность к энрофлоксацину, однако, является не только множественной резистентностью, но и сохранялась.
Отношение между резистентностью к энрофлоксацину и множественной резистентностью было также продемонстрировано в ходе пилотного мониторингового исследования приблизительно 400 патогенов кишечной палочки, полученных у собак или кошек. Модель резистентности различалась по регионам и составляла до 50% к амоксициллину или клавулановой кислоте и на юге приблизительно 30% к энрофлаксоцину. Хотя число штаммов, резистентных только к бета-лактамам (выражающее резистентность к одному препарату) была высокой, одиночная резистентность к энрофлоксацину была редкой. Если резистентность была выражена к энрофлоксацину, она по природе была множественной. Мы продолжаем исследование с использованием 3 000 штаммов в масштабах Соединенных Штатов, финансируемое Morris Animal Foundation и Idexx laboratories. В настоящее время региональные различия в резистентности сохраняются. Общая резистентность наиболее высока к цефалексину.
Лечение
Важнейшими соображениями при выборе антибактериальных препаратов являются в порядке приоритетов: 1) подтверждение необходимости лечения; 2) определение мишени для обеспечения соответствия препарата микробу; 3) обеспечение доставки препарата к месту инфекции; 4) корректировка дозировки для обеспечения концентрации, которая убьет все колонии инфекции.
Этот подход к лечению можно начать с определения того, является ли инфекция простой или неосложненной, так как это может определить потребность к культуре и проверке восприимчивости. Последнее соображение требует, чтобы были учтены факторы хозяина (например,воспаление) и факторы антибактериальных препаратов.
Международное общество инфекционных болезней домашних животных (ISCAID) предоставило рекомендации по лечению ИМП, и многие из этих принципов включены в данный анализ.
Простая неосложненная ИМП представляет собой спорадичную бактериальную инфекцию мочевого пузыря у здорового индивидуума с нормальной анатомией и функцией мочевых путей.
ИМП считается осложненной, если она возникает при наличии анатомических или функциональных нарушений или сопутствующего заболевания, которое делает пациента предрасположенным к хронической инфекции, рецидивирующей инфекции или неудачи лечения. Сопутствующие заболевания, осложняющие ИМП, могут включать в себя простатит, уролиты, нейрогенный мочевой пузырь, беременность, сахарный диабет или нарушения, ослабляющие иммунитет (у людей). Минимальные данные для оценки подозрения на ИМП должны включать в себя полный анализ мочи, включая удельный вес мочи, определение уровня глюкозы в моче и исследование осадка на наличие кристаллурии. Должны быть определены и по возможности вылечены первопричины инфекции. Инфекция с клиническими проявлениями означает присутствие клинических нарушений и характеризуется дизурией, поллакиурией и/или повышенными императивными позывами на мочеиспускание наряду с присутствием бактерий в моче. Ни один из этих симптомов не считается патогномоничным для инфекции. Кроме того, комиссия мне подтвердила необходимость лечения скрытой бактериурии / субклинической бактериурии при отсутствии клинических симптомов.
Субклиническая бактериурия представляет собой присутствие бактерий в моче в соответствии с определением позитивной бактериальной культуры при отсутствии клинических и цитологических доказательств ИМП. Лечение может не быть необходимым у животных, у которых отсутствуют клинические симптомы ИМП и свидетельства ИМП на основе исследования осадка в моче. В некоторых обстоятельствах может быть рассмотрено лечение, если присутствует возможность высокого риска восходящей или системной инфекции (например, пациенты с ослабленной иммунной системой, пациенты с предполагаемой почечной недостаточностью) или мочевой пузырь может быть очагом вне мочевой инфекции.
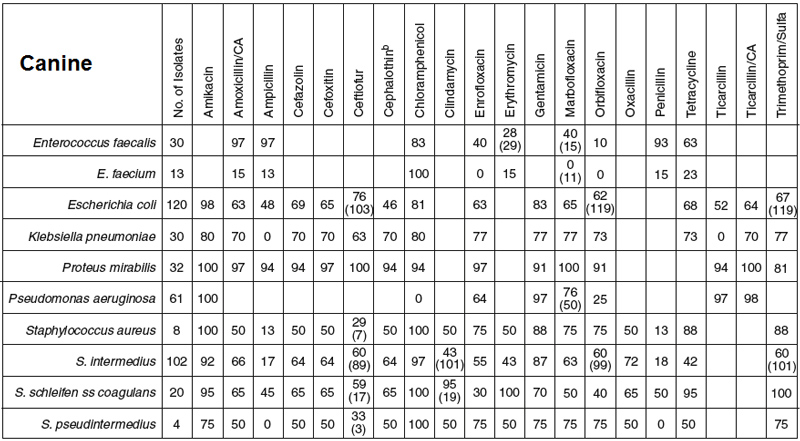 Рис. 1. Антибиограмма для собак, составленная в университетской клинике (2007-2010). Число штаммов приведено в первой колонке; процент штаммов, восприимчивых к лекарственным препаратам, указан в графе. Пустая графа указывает, что лекарственный препарат не походит для данного организма (например, цефалоспорины и Enterococcus). На основании этих данных примерно 50% штаммов E. coli резистентны к препаратам первого выбора (например, ампициллин, цефалотин [модельный препарат цефалексина]). Преимуществом амоксициллина в качестве первого выбора является также его эффект к отношении Enterococcus.
Рис. 1. Антибиограмма для собак, составленная в университетской клинике (2007-2010). Число штаммов приведено в первой колонке; процент штаммов, восприимчивых к лекарственным препаратам, указан в графе. Пустая графа указывает, что лекарственный препарат не походит для данного организма (например, цефалоспорины и Enterococcus). На основании этих данных примерно 50% штаммов E. coli резистентны к препаратам первого выбора (например, ампициллин, цефалотин [модельный препарат цефалексина]). Преимуществом амоксициллина в качестве первого выбора является также его эффект к отношении Enterococcus.
Эмпирический выбор. Для эмпирического подбора антибактериальных препаратов можно использовать антибиотикограммы (Рисунок 1). Отсутствуют объективные данные в отношении преобладания резистентности, указывающие на необходимость изменения изначальной терапии. Если начальная степень резистентности к данному препарату из объективного отбора проб превышает 10%, выбранный для начальной терапии препарат должен быть заменен другим из рекомендованного подбора (Таблица 1).
|
Drugs
|
Overall (n=1512)
|
95% Cl
|
Species
|
Gender
|
| Canine |
Feline |
Female |
Male |
| AMX C |
41.5 |
39.1-44.0 |
45.2 |
30 |
37.1 |
55.78 |
| AMP |
49.1 |
46.6-51.6 |
52.8 |
37.6 |
44.8 |
61.7 |
| CPF |
9.3 |
7.7-11.0 |
10.5 |
5.7 |
8.5 |
10.6 |
| CFT |
8.5 |
7.1-9.9 |
9.6 |
4.9 |
7.7 |
10.1 |
| CFO |
12.8 |
11.1-14.5 |
14.2 |
8.5 |
13.3 |
12.5 |
| CFP |
13.0 |
11.3-14.7 |
13.7 |
10.6 |
13.1 |
13.0 |
| CFZ |
8.9 |
7.5-10.5 |
10.4 |
4.4 |
8.3 |
10.6 |
| CPL |
98.9 |
98.2-99.3 |
99.0 |
98.6 |
99.0 |
99.3 |
| CHP |
12.6 |
11.0-14.3 |
13.7 |
9.3 |
12.2 |
13.8 |
| DXY |
15.6 |
13.8-17.4 |
15.63 |
15.5 |
15.9 |
14.7 |
| ENR |
10.5 |
8.8-12.3 |
11.69 |
6.7 |
9.9 |
11.5 |
| GEN |
7.9 |
6.6-9.3 |
8.56 |
6.0 |
7.8 |
8.1 |
| MRP |
1.3 |
0.7-2.0 |
1.05 |
1.9 |
1.6 |
1.0 |
| TCL |
19.4 |
17.5-21.4 |
20.79 |
15.3 |
20.5 |
17.7 |
| TMS |
8.9 |
7.4-10.3 |
9.69 |
6.3 |
8.6 |
8.4
|
В идеале эмпирическая терапия начинается с антибактериальных препаратов 1-го уровня. Соответствующий выбор включает в себя амоксициллин (11-15 мг/кг перорально каждые 8 часов; Boothe предлагает 20-25 мг/кг) или тритетоприм-сульфониламид (15 мг/кг перорально каждые 12 часов). Амоксициллин / клавуналовая кислота (12,5-25 мг/кг перорально каждые 8 часов) является приемлемым вариантом, но первоначально не рекомендуется ISCAID вследствие отсутствия доказательств необходимости клавуналовой кислоты и желания использовать самый узкий спектр, возможный при поддержании оптимального действия. Однако Boothe предлагает использовать ее, если окраска по Грамму и рН (щелочная) поддерживают Staphylococcus или Proteus в качестве инфицирующих организмов. Хотя только 60% кишечной палочки восприимчивы (Таблица 1), если пациент не получал антибактериальную терапию (неосложненную терапию), вероятно, что этот пациент входит в 60%. Амоксициллин (нет необходимости в клавуналовой кислоте) должен быть эффективным для большинства Enterococcus.
Лечение бактериальной ИМП представляет хороший пример того, как можно подходить к лечению бактериальных инфекций. Целью лекарственной терапии было уничтожение бактиурии, но эта цель должна быть изменена, чтобы включать в себя уничтожение инфекции при сведении к минимуму появление резистентности. Кроме того, вероятно, необходимо изменить цель в присутствии бессимптомных бактерий и может отсутствовать необходимость лечения системными антибактериальными препаратами. Для эмпирической терапии лечение может проводиться препаратами 1-го уровня, но по мере усиления инфекции следует рассмотреть препараты 2 и 3-го уровней.
2-ой уровень. Фторсодержащие хинолоны.
Предположим, что штамм, устойчивый к одному ФХ, устойчив ко всем. Если возникает резистентность к ФХ, это будет лекарственной резистентностью. Таким образом, фторхинолоны предпочтительно сохраняются во множественном качестве препаратов второго уровня, их применение основано на культуре и восприимчивости. Предпочтительно применение максимальных доз. В качестве препаратов в зависимости от концентрации дозы ФХ должны достигать, по меньшей мере, десятикратной МИК инфицирующего микроба в месте инфекции. Биодоступность ципрофлоксацина при пероральном введении у собак - 40-60% и у кошек - 0-20%. Хотя ципрофлоксацин более действенен в отношении грамотрицательных организмов, доза, однако, должна быть увеличена в два раза, по сравнению с энрофлоксацином, и в 3 раза для грамположительных. Пероральное введение ципрофлоксацина не следует применять для кошек. Для других фторхинолонов у кошек наиболее безопасными в отношении дегенерации сетчатки являются марбофлоксацин и, очевидно, орбифлоксацин. Хотя ФХ следует оставить для использования на основе культуры, одно исследование у собак показало, что 20 мг/кг энрофлоксацина раз в сутки перорально в течение 3 дней было так же эффективно, как амоксициллин-клавуналовая кислота 25 мг/кг два раза в сутки в течение 2 недель. Важным моментом является короткий период, но с высокой дозировкой.
3-ий уровень. К моменту достижения препаратов 3-го уровня критически важно устранить первопричину инфекции. Эта та группа, в отношении которой необходимо взвесить риски лечения относительно риска отсутствия лечения; следует внимательно рассмотреть отсутствие лечения бессимптомных пациентов.
Аминогликозиды. Рекомендуется проявлять осторожность, когда для аминогликозидов используются интервалы менее 24 часов. Контакт между препаратом и микробом в мочевых путях может быть обеспечен введением препарата непосредственно после мочеиспускания или до предполагаемого периода без мочеиспускания (например, ночью). Почечная токсичность, связанная с аминогликозидами, зависит от воздействия, что означает, что ее можно избежать, если почкам предоставляется период без воздействия лекарственных препаратов, в течение которого они могут выводить накопленный препарат. Соответственно, аминогликозиды назначают один раз в сутки. Поддержание восполнения потери жидкости (в случае обеспечения жидкостей, содержащих натрий, в период дозирования у пациентов с риском) и дозирование утром (возможно, вечером у кошек) могут сокращать токсичность так же, как исключение других нефроактивных препаратов (например, НПВС). N-ацетилцистеин может способствовать снижению риска или степени вреда.
Мы использовали мониторинг терапевтических препаратов у пациентов, получающих IV-аминогликозид в течение более 30 суток, для отслеживания изменений выведения, вызванных препаратами. Риски почечной токсичности и трудность применения аминогликозидов ограничивают варианты терапии.
Мультирезистентные грамположительные организмы
Резистентность к метициллину (MRSA; S. aureus; MRSP; S. intermedius [pseudintermedius] Множественная резистентность сейчас считается нормальной реакцией на антибиотики для грамположительных пневмококков, энтерококков и стафилококков. На резистентность к метициллину (MRSA; S. aureus; MRSP; S. intermedius [pseudintermedius] указывает присутствие mec А гена, который кодирует мутацию в пенициллинсвязывающем белке (ПСБ), в результате чего образуется ПСБ2а, а не ПСБ2. Соответственно, сокращается аффинность для бета-лактамоного кольца, что делает организм резистентным ко всем бета-лактамам. Такие протекторы, как клавулановая кислота, неэффективны. Обнаружение МРЗС или МРЗСП в пункции мочевого пузыря обычно основано на резистентности к оксациллину, который более стабилен, чем метициллин на дисках, используемых для тестов.
Однако лаборатории все более указывают на МРС, основанную на отсутствии восприимчивости к любому бета-лактаму. В нашей больнице приблизительно 25-30% Staphylococcus pseudintermedius демонстрируют резистентность к метициллину.
Антибиотики и в особенности цефалоспорины связаны с индукцией, отбором и распространением МРЗС. МРЗС у людей является внутрибольничной (внутрибольничная МРЗС, нозокомиальная), при этом встречается наиболее часто у пациентов с ослабленной иммунной системой в результате заболевания, лекарственных препаратов, процедур и продолжительности госпитализации; внебольничной (внебольничная МРЗС), при которой инфицируются в остальном здоровые люди (обычно кожные или мягкие ткани). Условия многолюдности, общие предметы и плохая гигиена повышают риск внебольничной инфекции. Хотя именно штамм внебольничной МРЗС USA300 оказывается наиболее связанным с увеличением образования колоний у собак и кошек, USA100, наиболее связанный с инфекциями приобретенной МРЗС у людей, наиболее часто связан с инфекциями у собак и кошек. Воздействие МРЗС в ветеринарии представляет все большую проблему не только вследствие ее воздействия на пациента, но и с точки зрения здравоохранения.
Ген mec был обнаружен у метициллин-резистентных организмов Staphylococcus aureus , инфицирующих собак, и МРЗС связан с инфекцией у собак. Однако МРЗС был также обнаружен у 4% здоровых собак, при этом идентификация затруднена необходимостью множественных мест отбора проб (носовая, ректальная или паховая области). Инфекция была выделена у членов семьи и домашних питомцев в одном доме, но это, скорее, означает передачу от людей домашним питомцам. Вероятно, что образование колоний является временным у животных. Однако здоровые питомцы оказались потенциальными резервуарами для передачи МРЗС здоровым владельцам и представляют риск для пациентов с ослабленной иммунной системой (люди и предположительно другие животные в одном доме).
Образование колоний МОЗС у людей несвойственно. Однако сообщалось о МРЗС как причине инфекции у людей, и была подтверждена передача от животных с пиодермией. Именно пациенты с очень ослабленной иммунной системой подвержены риску инфекции МРС, приобретенной от животного. В таких случаях переносчик или инфицированное животное должно быть удалено из среды до успешного лечения метициллин-резистентного стафилококка.
Гликопептиды, такие как ванкомицин, являются основными препаратами, используемыми для лечения МРЗС у людей, хотя появляется все больше стафилококковых инфекций, резистентных к ванкомицину (ВРЗС).
Разработка режима дозирования за пределами МИК
Несмотря на хорошее начало, достижение МИК у пациентов может быть недостаточным по различным причинам:
- Бактерицидный относительно бактериостатического препарата. Хотя стремление к бактерицидному препарату является верным, дозировка должна быть подобрана для обеспечения летальных концентраций. Это намного легче в случае бактерицидного препарата. С другой стороны, выбранные бактериостатические препараты могут убивать, в частности, при накоплении (например, макролиды и линкозамиды в фагоцитах; концентрация мочи).
- Концентрация, предотвращающая мутацию (КПМ). Так как каждый штамм в инфицирующем посевном материале имеет МИК, инфицирующая популяция характеризуется распределением МИК для каждого препарата. МИК, полученная из пункции мочевого пузыря, может быть средней (50 процентиль), при этом наиболее восприимчивы штаммы в нижнем конце. Штаммы в высоком конце представляют собой мутантные варианты и наименее восприимчивы к препарату. Действительно, если инфицирующий посевной материал достигает 105 – 7 КОЕ, спонтанные мутации позволят, по крайней мере, одному штамму выработать резистентность к любому препарату, который может применяться. Самая высокая МИК любого инфицирующего штамма в посевном материале является КПМ, и именно эта концентрация должна быть достигнута, чтобы убить мутантов и избежать возникновения резистентной популяции. Если концентрация препарата в месте инфекции достигает окна селекции мутантов (концентрация между МИК и КПМ), так как удалены наиболее восприимчивые штаммы, более резистентная популяция наполнит образовавшуюся пустоту. Как только новая популяция достигнет достаточного размера, инфекция возникнет снова. Новая популяция будет характеризоваться более высокой МИК по сравнению с первоначальной популяцией. Нормальный здоровый пациент может преодолеть эту инфекцию, но пациент группы риска не сможет. КПМ не может быть предсказана МИК, но в целом будет в 10 – 100 или больше раз выше МИК. Соответственно, режимы дозирования должны быть разработаны со значительным превышением МИК культуры (например, МИК90).
- Постантибиотический эффект (ПАЭ) и отношение между МИК и КПП. ПАЭ является продолженным ингибированием роста микробов после краткого воздействия препарата на организм. Воздействие ПАЭ на эффективность может быть значительным, в особенности для препаратов, зависимых от концентрации. Именно ПАЭ позволяет некоторым препаратам вводиться с большими интервалами. ПАЭ может отсутствовать для некоторых организмов или у некоторых пациентов (например, некоторые пациенты с ослабленной иммунной системой). В целом, препараты, зависимые от концентраций, демонстрируют более продолжительный ПАЭ. Продолжительность изменяется с пиковой КПП (т.е. выше = длиннее); ПАЭ усиливается комбинированной антибактериальной терапией.
- Концентрации в сравнении с временной зависимостью. Соотношение между МИК и величиной и продолжительностью КПП позволяет разделить препараты на две категории. Эффективность препаратов, зависимых от концентрации, наилучшим образом представленная ФХ и аминогликозидами, лучше всего прогнозируется соотношением пиковой концентрацией препарата в плазме (Cmax) по сравнению с МИК инфицирующего организма (Cmax:МИК). Для таких препаратов величина IQ обычно должна быть 8-10 или выше для более трудных инфекций (например, синегнойная палочка) или инфекций, вызванных множественными организмами. Продолжительность КПП выше МИК менее важна. Фактически эффективность может быть увеличена увеличением интервалов. Для таких препаратов особенно губительна низкая доза. Таким образом, должна использоваться самая высокая дозировка; это особенно важно для фторхинолонов (ФХ), так как резистентность всегда связана с множественной резистентностью. Например, целью в месте инфекции должна быть МИК 0,25, что означает 2,5 мкг/мл. Это делает необходимой дозу 15 – 20 мг/кг. Однако эффективность ФХ также связана с общим воздействием; соответственно, может быть показано введение два раза в сутки такой же высокой дозы для организмов, уже характеризующихся резистентностью низкого уровня (см. MPC ниже). Для препаратов с временной зависимостью (например, -лактамы) эффективность увеличивается, если КПП остается выше МИК [T> МИК] для большинства (60 - 70% или более) интервалов дозирования. Для таких препаратов простое достижение МИК недостаточно, так как КПП (и, конечно, концентрация в тканях) немедленно опускается ниже МИК. При препаратах с временной зависимостью Cmax: МИК может быть полезным, но выбор препарата с более длительным периодом полувыведения важен, так как концентрации препарата уменьшаются на 50% с каждым периодом полувыведения препарата, отношение Cmax:МИК, равное двум, приведет к тому, что КПП будет ниже МИК в одном периоде полувыведения. Интервалы дозирования могут составлять два периода полувыведения. Для увеличения интервалов дозирования еще на два периода полувыведения дозировка должна быть удвоена; чтобы добавить еще два периода полувыведения, дозировка должна быть увеличена в четыре раза. Например, для Staphylococcus pseudintermedius при МИК для цефалексина 2 мкг/мл (период полувыведения приблизительно 3 часа) КПП достигает приблизительно 20 мкг/мл при дозировке 25 мг/кг. В одном периоде полувыведения (3 часа) КПП упала до 10; через 6 часов до 5. Таким образом, может быть приемлем интервал дозирования 12 часов. Однако это предполагает, что весь препарат в плазме достиг тканей и что период полувыведения составляет 3 часа. В противоположность этому для амоксициллина дозировка 13 мг/кг дает результат 4 мкг/мл в плазме с периодом полувыведения приблизительно 1,5 часа. 90% препарата выводится за 4,5 часа (интервал дозирования 9 часов), и воздействовать такой дозировкой каждые 8 часов можно только на штаммы с очень низкой МИК. Мы рекомендуем 25 мг/кг каждые 8 часов и только для очень восприимчивых штаммов. Выбор препаратов с временной зависимостью с длительным периодом полувыведения должен быть осторожным.
- Проникновение в место инфекции. В целом, следует избегать “I” препаратов. Местная терапия позволит достичь высоких концентраций. Для ИМП инфекция находится в мочевом пузыре, покрытом биопленкой; кроме того, не все пациенты имеют концентрированную мочу. Таким образом, предположение о том, что наличие высоких концентраций в моче исключает необходимость повышения дозы, является неразумным. Даже в тканях, досягаемых для действия цитостатических препаратов, принимаем, что только 30-50% водорастворимых препаратов (бета-лактамы, аминогликозиды) распределяются во внеклеточной жидкости. Таким образом, дозировка должна быть автоматически удвоена, если основываться на МИК в плазме. Дозировка должна быть далее увеличена для не фенестрированных тканей. Заметная воспалительная реакция хозяина делает необходимой очистку места. Может быть разумным использование препаратов, накапливающихся в белых кровяных тельцах (ФХ, макролиды, клиндамицин). Большинство инфекций связаны с биопленкой, которая является непреодолимым барьером для проникновения лекарственного препарата. По возможности следует удалить посторонние тела, чтобы уменьшить действие биопленки.
Продолжительность терапии
Продолжительность лечения любой инфекции не является ясным вопросом; однако, в целом, рассмотрите более высокие дозы, меньшие интервалы и по возможности меньшую продолжительность.
Пиелонефрит. Критерии интерпретации пункции мочевого пузыря должны быть основаны на сыворотке. Лечение должно быть начато немедленно. При наличии вспомогательных данных области разумным первым выбором является лечение фторхилононом, выводимым в моче в активной форме (например, не дифлоксацин). При восходящей инфекции можно рассмотреть предварительный диагноз нижней ИМП на основе полученных результатов культуры мочи; при гематогенной инфекции начальная терапия должна базироваться на культурах крови или инфицированного участка. Часто рекомендуется лечение в течение 4-6 недель, хотя может быть эффективна меньшая продолжительность терапии. Следует выполнить анализ мочи и культуры через 1 неделю после начала лечения вследствие потенциальной тяжести заболевания и длительного периода лечения. Если будет изолирован тот же организм, следует рассмотреть добавление по возможности антибактериального препарата, к которому организм чувствителен в лабораторных условиях. Рекомендуется консультация специалиста.
Мультирезистентные инфекции. Организмы (например, различные энтеробактерии, стафилококки и энтерококки) могут представлять проблему для здравоохранения в отношении возможности зоонозной передачи резистентных патогенов. Поддерживается продуманное применение препаратов людьми при соблюдении определенных критериев (см. опубликованные рекомендации).

 Рис. 1. Антибиограмма для собак, составленная в университетской клинике (2007-2010). Число штаммов приведено в первой колонке; процент штаммов, восприимчивых к лекарственным препаратам, указан в графе. Пустая графа указывает, что лекарственный препарат не походит для данного организма (например, цефалоспорины и Enterococcus). На основании этих данных примерно 50% штаммов E. coli резистентны к препаратам первого выбора (например, ампициллин, цефалотин [модельный препарат цефалексина]). Преимуществом амоксициллина в качестве первого выбора является также его эффект к отношении Enterococcus.
Рис. 1. Антибиограмма для собак, составленная в университетской клинике (2007-2010). Число штаммов приведено в первой колонке; процент штаммов, восприимчивых к лекарственным препаратам, указан в графе. Пустая графа указывает, что лекарственный препарат не походит для данного организма (например, цефалоспорины и Enterococcus). На основании этих данных примерно 50% штаммов E. coli резистентны к препаратам первого выбора (например, ампициллин, цефалотин [модельный препарат цефалексина]). Преимуществом амоксициллина в качестве первого выбора является также его эффект к отношении Enterococcus.